貴州個(gè)性化臨床前動(dòng)物實(shí)驗(yàn)多少錢(qián)
下面提供了關(guān)于臨床前動(dòng)物實(shí)驗(yàn)研究監(jiān)測(cè)的具體建議:(1)術(shù)中監(jiān)測(cè):術(shù)中和術(shù)后對(duì)心率、心電圖、血壓和血?dú)獾谋O(jiān)測(cè)有助于獲得積極結(jié)果。(2)急性(短期)研究:建議**記錄生命體征,如手術(shù)時(shí)記錄的心律、呼吸頻率、脈搏和血壓。這些信息應(yīng)與植入、放置或使用裝置、造影劑或其他裝置相關(guān)材料的時(shí)間相關(guān)聯(lián),并在麻醉和手術(shù)記錄中注明。(3)慢性(長(zhǎng)期)研究:慢性研究包括如下不同時(shí)期:①術(shù)后護(hù)理:建議遵循目前的實(shí)驗(yàn)室實(shí)驗(yàn)動(dòng)物護(hù)理標(biāo)準(zhǔn),保持動(dòng)物體溫正常,盡量減少疼痛和***,并提供充足的液體和電解質(zhì)。獲取動(dòng)物生理信息的質(zhì)量應(yīng)與人類護(hù)理和康復(fù)中所獲得的信息相類似。此外,還應(yīng)建立一個(gè)標(biāo)準(zhǔn)評(píng)估模式來(lái)控制壓力變量,以監(jiān)測(cè)疼痛和體溫,并根據(jù)中期結(jié)果指導(dǎo)額外的保溫和止痛藥使用。英瀚斯是專業(yè)的醫(yī)療器械臨床前動(dòng)物實(shí)驗(yàn)外包公司。貴州個(gè)性化臨床前動(dòng)物實(shí)驗(yàn)多少錢(qián)
臨床前動(dòng)物實(shí)驗(yàn)中動(dòng)物模型選擇的思路應(yīng)遵循以下原則:一是要大程度地模擬預(yù)期臨床應(yīng)用的實(shí)驗(yàn)系統(tǒng),包括動(dòng)物及其相關(guān)環(huán)境和生理特性。二是動(dòng)物實(shí)驗(yàn)研究實(shí)施的合理性,風(fēng)險(xiǎn)分析要素應(yīng)涉及為什么選擇該動(dòng)物模型。如果動(dòng)物模型有局限性,器械的一些相關(guān)風(fēng)險(xiǎn)要通過(guò)實(shí)驗(yàn)室或者尸體實(shí)驗(yàn)進(jìn)行評(píng)價(jià),并確定其相關(guān)性。除此之外,還應(yīng)確定實(shí)驗(yàn)系統(tǒng)的遺傳學(xué)差異(動(dòng)物和人的差異)。如實(shí)驗(yàn)系統(tǒng)和人的不同、器械的尺寸和輸送系統(tǒng)差異、器械植入的部位和追蹤方式差異,等等。醫(yī)療器械的安全性評(píng)估通常基于所提供有效科學(xué)證據(jù)的動(dòng)物實(shí)驗(yàn)研究,應(yīng)具有適當(dāng)?shù)臉?biāo)準(zhǔn)操作規(guī)程,以確保數(shù)據(jù)的質(zhì)量和完整性。研究機(jī)構(gòu)應(yīng)當(dāng)制定與其業(yè)務(wù)相適應(yīng)的標(biāo)準(zhǔn)操作規(guī)程。關(guān)于需要制定的標(biāo)準(zhǔn)操作規(guī)程可參考《藥物非臨床研究質(zhì)量管理規(guī)范》第七章的合計(jì)15項(xiàng)條款。建議動(dòng)物實(shí)驗(yàn)研究包括適當(dāng)?shù)目刂拼胧┮员M量減少實(shí)驗(yàn)的變異性和差錯(cuò)。這樣的措施包括但不限于在試驗(yàn)過(guò)程中盡量減少影響實(shí)驗(yàn)動(dòng)物的因素。甘肅有什么臨床前動(dòng)物實(shí)驗(yàn)評(píng)價(jià)生物藥臨床前動(dòng)物實(shí)驗(yàn)外包;
專業(yè)臨床前動(dòng)物實(shí)驗(yàn)就找英瀚斯。在人類正常的科學(xué)研究歷史上,并沒(méi)有建立“人類***模型”的先例。更重要的問(wèn)題是,它可能就不考慮設(shè)置對(duì)照組了。以動(dòng)物疫苗的臨床試驗(yàn)舉例說(shuō),很多動(dòng)物疫苗可在本種動(dòng)物身上進(jìn)行臨床動(dòng)物實(shí)驗(yàn),當(dāng)拿病毒去攻疫苗免疫過(guò)后的動(dòng)物時(shí),通常需要設(shè)置的是不同劑量的對(duì)照組,比較簡(jiǎn)單的也需要設(shè)兩個(gè)組,一組是注射疫苗組,一組是注射鹽水等其他安慰劑的組,當(dāng)結(jié)果表明前者未發(fā)病,后者發(fā)病了,才能說(shuō)明疫苗有效。事實(shí)上,全球?qū)τ诓《疽呙绲难邪l(fā)速度堪稱“前所未有”。
建議在臨床前動(dòng)物實(shí)驗(yàn)設(shè)計(jì)中設(shè)置一個(gè)對(duì)照組,或解釋為什么不設(shè)置對(duì)照組。此外,應(yīng)使用足夠數(shù)量的動(dòng)物來(lái)支持醫(yī)療器械安全性和性能的驗(yàn)證結(jié)果。動(dòng)物數(shù)量的確定比較好在臺(tái)架測(cè)試和器械的迭代研究完成之后。研究中動(dòng)物的數(shù)量應(yīng)基于合理的科學(xué)依據(jù),并考慮到模型的難度,以及是否可在一只動(dòng)物中合理研究一種或多種受試物和對(duì)照品。根據(jù)經(jīng)驗(yàn),較高級(jí)物種(例如,綿羊、山羊、非人靈長(zhǎng)類動(dòng)物)的典型動(dòng)物實(shí)驗(yàn)研究通常每組/時(shí)間點(diǎn)有3~9只動(dòng)物。但是,在任何情況下,方案中都應(yīng)提供所用動(dòng)物數(shù)量的科學(xué)依據(jù)。中成藥臨床前動(dòng)物實(shí)驗(yàn)價(jià)格;
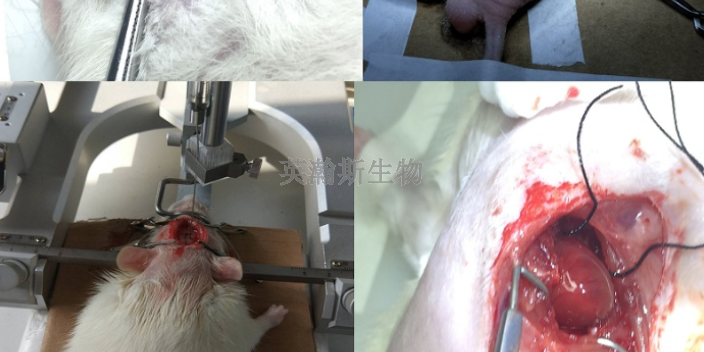
臨床前動(dòng)物實(shí)驗(yàn)安全性與有效性的關(guān)系:醫(yī)療器械臨床前動(dòng)物實(shí)驗(yàn)的主要目的是研究其安全性;生物相容性是醫(yī)療器械安全性的特征之一(如血液相容性和細(xì)胞毒性);有效性不是臨床前評(píng)價(jià)的主要方向,而是它包含一定程度的有效性內(nèi)容;建立適當(dāng)?shù)哪P涂梢蕴岣哂行匝芯康乃剑梢宰鳛榕R床前評(píng)價(jià)的重要內(nèi)容,即試驗(yàn)裝置的實(shí)際使用與預(yù)期使用的符合性。但這類研究成果不能作為醫(yī)療器械有效性評(píng)價(jià)的客觀依據(jù),只能作為能否轉(zhuǎn)移到人體進(jìn)行臨床研究的輔助參考。對(duì)有效性的客觀研究是不現(xiàn)實(shí)的,有時(shí)只是廠家一廂情愿地在動(dòng)物實(shí)驗(yàn)中驗(yàn)證醫(yī)療器械的有效性。但也有一些例外,如結(jié)構(gòu)性心臟病器械、血管疾病器械、止血材料等,都可以得到一定程度的驗(yàn)證。無(wú)論實(shí)驗(yàn)?zāi)P腿绾卧O(shè)計(jì),都與器械預(yù)期使用的人體對(duì)象存在較大差異;很難設(shè)計(jì)和完成完全符合或接近預(yù)期人體對(duì)象的動(dòng)物模型;醫(yī)療器械的臨床研究是其有效性驗(yàn)證的關(guān)鍵階段,也是其安全性的另一個(gè)驗(yàn)證(確認(rèn))階段。化學(xué)藥臨床前動(dòng)物實(shí)驗(yàn)公司;遼寧專業(yè)臨床前動(dòng)物實(shí)驗(yàn)
生物藥臨床前動(dòng)物實(shí)驗(yàn)是什么?貴州個(gè)性化臨床前動(dòng)物實(shí)驗(yàn)多少錢(qián)
臨床前動(dòng)物實(shí)驗(yàn),TGN1412是TeGenero的較早產(chǎn)品,從生產(chǎn)到進(jìn)入臨床試驗(yàn)才2年多時(shí)間,從MHRA批準(zhǔn)TGN1412進(jìn)入臨床試驗(yàn)到試驗(yàn)開(kāi)始總共才45天。ESG指出,雖然臨床前動(dòng)物實(shí)驗(yàn)沒(méi)有發(fā)現(xiàn)嚴(yán)重不良反應(yīng),但不能因此估測(cè)出一個(gè)TGN1412用于人類的安全劑量,藥物的安全性未得到充分論證。實(shí)施臨床試驗(yàn)的研究者沒(méi)有受到良好培訓(xùn),志愿者對(duì)可能發(fā)生的危險(xiǎn)也了解不足。媒體和公眾都指責(zé)MHRA為了吸引醫(yī)藥公司到英國(guó)進(jìn)行臨床研究而放寬了藥物臨床研究的審批。從而使一家*有15名雇員、風(fēng)險(xiǎn)資本驅(qū)動(dòng)的德國(guó)小公司不在本國(guó)進(jìn)行臨床試驗(yàn),卻轉(zhuǎn)而選擇英國(guó)。貴州個(gè)性化臨床前動(dòng)物實(shí)驗(yàn)多少錢(qián)
南京英瀚斯生物科技有限公司總部位于南京市棲霞區(qū)燕子磯街道和燕路371號(hào)東南大學(xué)國(guó)家大學(xué)科技園科創(chuàng)樓A311,是一家醫(yī)學(xué)實(shí)驗(yàn)外包、動(dòng)物實(shí)驗(yàn)外包、細(xì)胞實(shí)驗(yàn)外包、分子實(shí)驗(yàn)檢測(cè)、病理染色檢測(cè)、科研實(shí)驗(yàn)外包、動(dòng)物模型構(gòu)建、第三方檢測(cè)、病理組織切片、細(xì)胞培養(yǎng)、電生理檢測(cè)、醫(yī)學(xué)研究和試驗(yàn)發(fā)展、生物醫(yī)藥技術(shù)研發(fā)、技術(shù)轉(zhuǎn)讓、技術(shù)咨詢及技術(shù)服務(wù)的公司。公司自創(chuàng)立以來(lái),投身于實(shí)驗(yàn)外包,動(dòng)物模型構(gòu)建,細(xì)胞分子實(shí)驗(yàn),病理檢測(cè),是醫(yī)藥健康的主力軍。英瀚斯生物始終以本分踏實(shí)的精神和必勝的信念,影響并帶動(dòng)團(tuán)隊(duì)取得成功。英瀚斯生物始終關(guān)注醫(yī)藥健康市場(chǎng),以敏銳的市場(chǎng)洞察力,實(shí)現(xiàn)與客戶的成長(zhǎng)共贏。
- 浙江腦缺血再灌注模型多少錢(qián) 2025-01-22
- 廣東MCO腦缺血再灌注模型制作 2025-01-22
- 遼寧推薦的腦缺血再灌注模型價(jià)格 2025-01-22
- 西藏哪家做腦缺血再灌注模型公司 2025-01-21
- 遼寧專門(mén)做腦缺血再灌注模型制作 2025-01-21
- 云南專門(mén)做腦缺血再灌注模型多少錢(qián) 2025-01-21
- 山東比較好的腦缺血再灌注模型實(shí)驗(yàn) 2025-01-20
- 內(nèi)蒙古專門(mén)做腦缺血再灌注模型 2025-01-20
- 福建腦缺血再灌注模型價(jià)格 2025-01-20
- 遼寧比較好的腦缺血再灌注模型檢測(cè) 2025-01-19
- 麗水代理奧托博克假肢公司 2025-01-22
- 陜西無(wú)菌海藻糖現(xiàn)貨供應(yīng) 2025-01-22
- 廣東糞菌群移植廠家直銷 2025-01-22
- 南京搖床搖瓶直銷價(jià) 2025-01-22
- 綜合ELISA試劑盒 2025-01-22
- 陜西齒科氧化鋅口腔耗材精選廠家 2025-01-22
- 矯形助行器 2025-01-22
- 河南快速牙托粉顏色 2025-01-22
- 廣州遠(yuǎn)紅外小兒***貼貼牌現(xiàn)貨直發(fā) 2025-01-22
- 廣西濟(jì)南脂質(zhì)體載藥 2025-01-22