湖南專業臨床前動物實驗指標
臨床前動物實驗由于現代科學技術的進步,疫苗抗原制備的速度可以很快。就**疫苗而言,全世界的研究者都得益于中國科學院武漢病毒研究所的基因序列公布。張改平說,我們追求的是安全、高效、不浪費免疫潛力的疫苗,在進行了臨床前動物實驗的前提下,力爭把特定疫苗做到它現代科學技術條件下的比較高境界。所謂免疫潛力,作為生理潛力的組成部分,人、動物都非常強大。在正常情況下,這些能力是用于生長、抗逆、工作、學習和生產(就動物而言)等的,若一個疫苗而過多使用(抗原不夠高效、免疫次數多、免疫劑量大等),就會影響其它方面,同時也因機體免疫系統承受壓力過大而免疫保護效果欠佳。浪費免疫潛力的情況以往沒有被高度重視。生物藥臨床前動物實驗包括哪些?湖南專業臨床前動物實驗指標
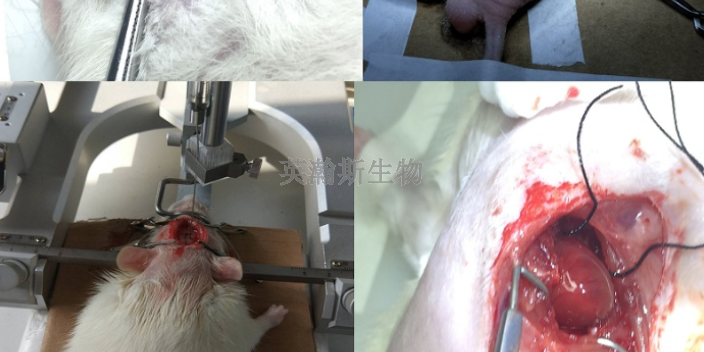
申請人應盡臨床前動物實驗的可能通過初步研究(如實驗室研究等)來驗證所確定的風險控制措施的有效性,只有在實驗室研究不足時,才能通過動物實驗進行進一步驗證。動物實驗數據可作為風險/收益分析的支持數據。1.可行性研究:可行性研究是指在產品設計和開發階段,為確認/驗證產品的工作原理、作用機理、設計、可操作性、功能性、安全性等方面,或識別新的意外風險而進行的研究。2.安全性研究:申請人采取風險控制措施后,可通過動物實驗對部分產品的安全性進行適當評價。3.有效性研究:盡管某些醫療器械在動物和人類之間的有效性可能存在一些差異,但合理設計的動物實驗可以支持產品的有效性(包括性能和操作)。湖南高質量臨床前動物實驗指標化學藥臨床前動物實驗中心;
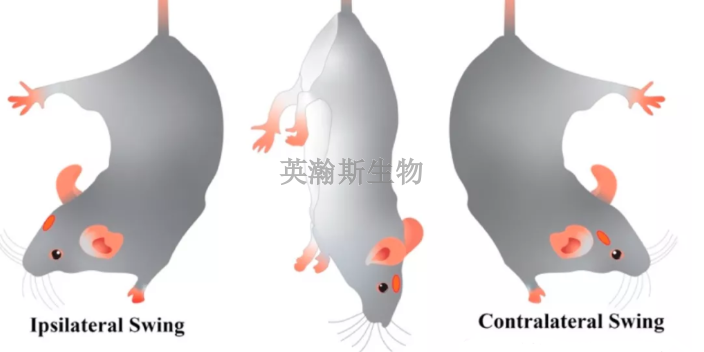
臨床前動物實驗就在英瀚斯一站式實驗中心。凡是沒有經過院方倫理委員會的審核,一般是不合乎規范的。合乎規范也頗值得琢磨。有的是法律,有的是行政管理,有的是行業認可的標準,比如針對臨床***的一些共識等。現在的問題是,沒有一個統一的規范,也就很難定義違不違規了。對此,首先是要完善干細胞***的基礎研究,踏踏實實完成從臨床前動物實驗到臨床試驗的過程,不可急功近利。同時,技術需要創新和嘗試,由此帶來的風險要靠嚴格的規范去控制,但不能因為害怕承擔可能的風險,使規則的制定都停滯不前。
我國醫療器械臨床前安全性評價還沒有實施GLP管理,但要求開展醫療器械生物學評價試驗機構需要具備中國合格評定國家認可委員會(China National Accreditation Service for Conformity Asse ssme nt,CNAS)及中國計量認證(Chi na Metrology Accreditation,CMA)認可的實驗室資質,而對開展臨床前動物實驗研究還沒有明確的資質要求。GLP管理與CNAS認證體系雖然是兩個不同的質量管理體系,但基本內容有很多的相同性和相似性。如果參照我國相關醫療器械動物實驗研究指導原則和國家或行業標準,在具備CNAS及CMA認可資質的實驗室質量管理體系下開展醫療器械臨床前動物實驗研究,可以基本滿足臨床前動物實驗研究質量管理要求。生物藥臨床前動物實驗機構;
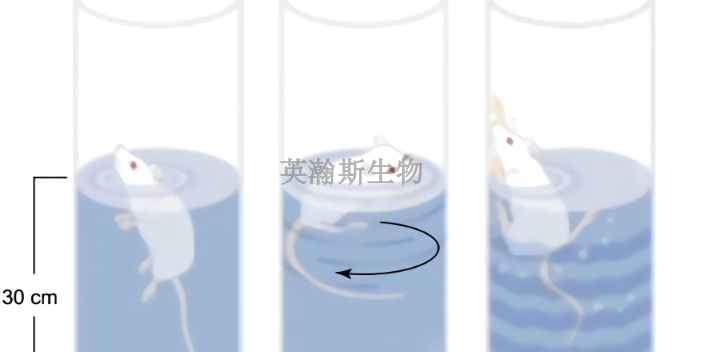
臨床前動物實驗,科學家可以了解從神經元的真實生物物理模型,它們的動態交互關系以及神經網絡的學習,到腦的組織和神經類型計算的量化理論等,并從計算角度理解腦,研究非程序的、適應性的、大腦風格的信息處理的本質和能力,探索新型的信息處理機理和途徑。也就是說,借助這種方法,未來科學家可以對大腦進行結構和功能的模擬。計算神經科學中的模型并不是憑空創造的,它們依然是基于實驗,從中得到數據才可以構建的。而比較終測試模型是否成立,依然需要回歸到實驗中去檢驗。因此,臨床前動物實驗和人體試驗不可替代。化藥臨床前動物實驗包括哪些?吉林比較好的臨床前動物實驗機構
化學藥臨床前動物實驗機構;湖南專業臨床前動物實驗指標
新藥往往需要臨床前動物實驗,從設計到上市通常需要10-15年的時間,經歷漫長的研發過程和層層考驗,同時需要大量的資本投入。藥物通過發現篩選、臨床前研究、臨床試驗、新藥NMPA/FDA上市申報等環節,比較終成為穩定、安全、有效的藥品,惠及人類健康。其中的每個研究階段都至關重要,特別是臨床前藥物研究獲得的結果對藥物進入臨床提供關鍵的數據指導,為優化臨床開發計劃提供有力的數據基礎。臨床前動物實驗是其中非常重要的一環,起到承上啟下的作用。湖南專業臨床前動物實驗指標
- 浙江腦缺血再灌注模型多少錢 2025-01-22
- 廣東MCO腦缺血再灌注模型制作 2025-01-22
- 遼寧推薦的腦缺血再灌注模型價格 2025-01-22
- 西藏哪家做腦缺血再灌注模型公司 2025-01-21
- 遼寧專門做腦缺血再灌注模型制作 2025-01-21
- 云南專門做腦缺血再灌注模型多少錢 2025-01-21
- 山東比較好的腦缺血再灌注模型實驗 2025-01-20
- 內蒙古專門做腦缺血再灌注模型 2025-01-20
- 福建腦缺血再灌注模型價格 2025-01-20
- 遼寧比較好的腦缺血再灌注模型檢測 2025-01-19
- 麗水代理奧托博克假肢公司 2025-01-22
- 陜西無菌海藻糖現貨供應 2025-01-22
- 廣東糞菌群移植廠家直銷 2025-01-22
- 南京搖床搖瓶直銷價 2025-01-22
- 綜合ELISA試劑盒 2025-01-22
- 陜西齒科氧化鋅口腔耗材精選廠家 2025-01-22
- 矯形助行器 2025-01-22
- 河南快速牙托粉顏色 2025-01-22
- 廣州遠紅外小兒***貼貼牌現貨直發 2025-01-22
- 廣西濟南脂質體載藥 2025-01-22