海南RNA蛋白互作RIP測序檢測
RNA結合蛋白免疫沉淀(RIP)是一種重要的分子生物學實驗技術,其應用場景主要集中在以下幾個方面:1.細胞內RNA與蛋白結合情況的研究:RIP可以用于研究細胞內RNA與特定蛋白質的結合情況,揭示RNA在基因表達調控、轉錄后修飾、蛋白質合成等過程中的作用。2.RBP與非編碼RNA的相互作用研究:非編碼RNA,如長鏈非編碼RNA(lncRNA)和微小RNA(miRNA)等,在基因表達調控中起著重要作用。RIP技術可以用于發現和研究RBP(RNA結合蛋白)與非編碼RNA的相互作用,有助于深入理解非編碼RNA的功能和調控機制。3.全基因組范圍的RNA與RBP相互作用圖譜的繪制:通過RIP技術,可以繪制全基因組范圍的RNA與RBP相互作用圖譜,從而揭示RNA與蛋白質的相互作用網絡,為理解基因表達的復雜調控機制提供重要依據。RIP-seq是一種用于研究細胞內RNA與蛋白質結合情況的高通量測序技術。海南RNA蛋白互作RIP測序檢測
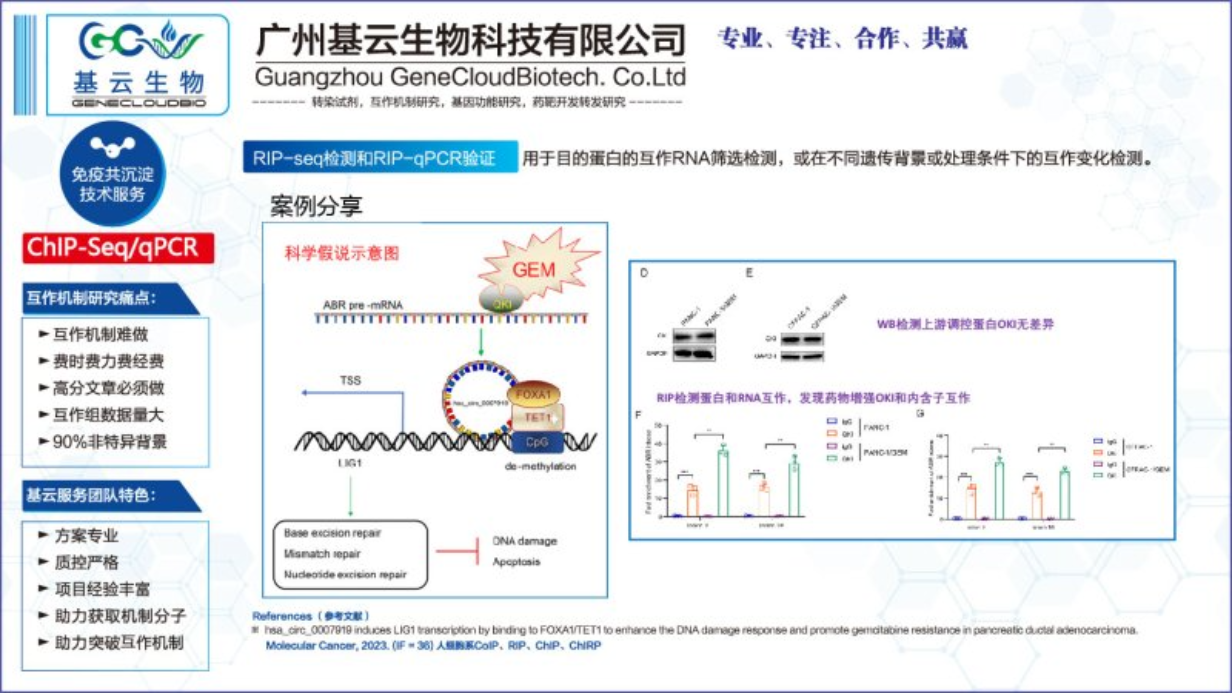
RIP-seq實驗的基本實驗流程如下:準備樣本:收集并處理適當的細胞或組織樣本,確保樣本的質量和數量滿足實驗需求。免疫沉淀:利用特定蛋白的抗體,通過免疫沉淀技術將RNA-蛋白質復合物從樣本中分離出來。這一步驟能夠確保只捕獲與目標蛋白結合的RNA分子。破碎與文庫制備:將捕獲的RNA-蛋白質復合物進行破碎處理,釋放出RNA分子,并制備成測序文庫。這一步驟涉及RNA的純化和逆轉錄等過程,以便進行后續的測序分析。高通量測序:利用高通量測序技術對制備好的RNA測序文庫進行測序,獲得大量的測序數據。這些數據將用于分析RNA與蛋白質的相互作用。數據分析:對測序數據進行生物信息學分析,包括序列比對、峰值調用和注釋等步驟,以識別與特定蛋白結合的RNA序列,并揭示它們在細胞內的功能和調控機制。整個實驗流程需要嚴格控制實驗條件,確保實驗的特異性和準確性。通過RIP-seq實驗,可以詳細了解RNA與特定蛋白質的相互作用情況,為深入研究基因表達調控和細胞生物學過程提供有力支持。湖南互作機制RIPRIP-seq實驗廣泛應用于研究全基因組RNA-蛋白質相互作用及轉錄后調控機制。
在進行RIP-qPCR實驗時,也需要注意以下問題以確保實驗的精確性和可靠性:實驗優化:雖然RIP-qPCR的基本步驟是固定的,但應該根據具體的研究對象和實驗條件,對實驗流程進行細化和優化,以提高實驗的效率和準確性。抗體驗證:抗體的質量和特異性對RIP實驗的結果至關重要。應該使用經過充分驗證的抗體,或者在實驗前對抗體進行嚴格的驗證。對照設置:除了實驗組和對照組的基本設置外,還應該考慮設置更多的對照實驗,如使用不同的抗體或不同的細胞系,以更好地驗證實驗結果。數據標準化:在數據分析階段,應該使用適當的標準化方法,如內參基因校正、樣品間歸一化等,以減少實驗誤差,提高數據的可比性。結果驗證:即使得到了預期的實驗結果,也應該使用其他方法進行結果的驗證,如Westernblot、免疫熒光等,以確保結果的準確性和可靠性。注意這些問題將有助于更好地利用RIP-qPCR技術進行科學研究。
若想要快速了解RIP-qPCR實驗技術,你可以采取以下幾種方法。首先,查閱實驗技術手冊或在線教程,這些資源通常會提供RIP-qPCR的詳細步驟、實驗原理以及關鍵注意事項。通過閱讀這些資料,你可以對該技術有一個大致的了解。其次,觀看相關的教學視頻或實驗演示。這些視覺材料能夠直觀地展示實驗流程,幫助你更好地理解和掌握RIP-qPCR技術。此外,參加相關的學術研討會或實驗技術培訓課程也是一個不錯的選擇。與同行大牛面對面交流,你可以獲得更深入的見解和實用的建議。實際動手進行實驗是掌握RIP-qPCR技術的關鍵。在實驗室中,你可以嘗試按照標準流程進行RIP-qPCR實驗,并結合實驗結果來分析和優化實驗條件。通過實踐,你將能夠更深入地理解實驗原理,掌握實驗技巧,并積累寶貴的實驗經驗。綜上所述,通過查閱專業的資料、觀看教學視頻、參加學術交流和實際動手實驗,你可以快速了解并掌握RIP-qPCR實驗技術。不斷學習和實踐將使你在這項技術上更加熟練和自信。RIP實驗通常需要進行抗體預實驗。抗體預實驗在RIP實驗中扮演著重要的角色。

做好RIP-qPCR實驗,應該注意以下幾個關鍵問題。首先,實驗設計至關重要。明確實驗目的,選擇合適的對照組,如使用非特異性抗體作為陰性對照,確保結果的準確性。同時,對實驗條件進行優化,包括抗體濃度、反應時間等,以獲得較好的實驗效果。其次,樣本處理需格外小心。在收集和處理樣本時,要防止RNA降解,使用無RNase的試劑和耗材,并盡可能在低溫下進行操作。此外,樣本的均一性和代表性也是實驗成功的關鍵。再者,引物設計不容忽視。引物應具有高特異性和適當的退火溫度,以避免非特異性擴增和引物二聚體的形成。同時,引物應跨越內含子或位于不同外顯子上,以排除基因組DNA的污染。此外,實驗操作要規范。嚴格遵守RNA操作規范,避免RNA酶的污染。在加樣、PCR反應等步驟中,要確保準確性和可重復性另外,數據分析要科學。使用適當的統計方法分析實驗數據,確保結果的可靠性和有效性。同時,對異常值或不符合預期的結果進行深入分析,找出可能的原因。總之,做好RIP-qPCR實驗需要注意實驗設計、樣本處理、引物設計、實驗操作和數據分析等方面的問題。只有充分考慮并處理好這些問題,才能獲得準確、可靠的實驗結果。RIP實驗是一種強大的技術,用于研究細胞內RNA與蛋白質的相互作用。廣東RNA蛋白相互作用檢測RIP-RT-PCR檢測
RIP-qPCR實驗技術是一種研究細胞內RNA與蛋白質相互作用的重要方法,具有廣泛的應用場景。海南RNA蛋白互作RIP測序檢測
RIP-qPCR實驗的引物設計至關重要,它直接影響到實驗的特異性和靈敏度。以下是引物設計的主要要求。特異性:引物應具有高特異性,確保只擴增目標RNA分子,避免非特異性擴增。設計時,應避免與其他基因或RNA存在互補序列。長度與GC含量:引物長度通常在18-25bp之間,GC含量適中(40%-60%),以保證引物的穩定性和退火效率。避免引物二聚體:引物間不應存在互補序列,特別是3’端,以防止引物二聚體的形成。跨內含子設計:對于基因編碼區的RNA,引物盡量跨越內含子設計,以避免基因組DNA的污染。3’端修飾避免:引物的3’端不能進行任何修飾,且必須是G或C,因為這兩種堿基配對較為穩定,有利于引物的延伸。引物自身互補性:引物自身不應存在互補序列,以避免折疊成發夾結構,影響引物與模板的結合。與模板緊密互補:引物應與模板序列緊密互補,確保PCR的高效擴增。遵循這些要求設計的引物,將大程度提高RIP-qPCR實驗的準確性和可靠性。在實驗前,還應對設計的引物進行驗證,確保其滿足實驗需求。海南RNA蛋白互作RIP測序檢測
- 浙江RNA蛋白互作RIP測序 2024-11-29
- 湖北RNA蛋白互作檢測RIP測序檢測 2024-11-29
- 湖南RIP-Sequence檢測 2024-11-28
- 廣東RIP-Sequencing檢測 2024-11-28
- 上海免疫沉淀CoIP-Mass檢測 2024-11-27
- 陜西免疫沉淀CoIP Mass檢測 2024-11-27
- 貴州RNA免疫共沉淀RIP-RT-PCR 2024-11-26
- 浙江RNA蛋白互作RIP-Seq 2024-11-26
- 四川互作蛋白檢測CoIP-mass spectrometry檢測 2024-11-25
- 北京RNA免疫共沉淀RIP-RT-PCR 2024-11-25
- 深圳備孕凝膠多少錢 2024-12-23
- 河北莫諾苯宗供應商 2024-12-23
- 海洋生物外泌體蛋白質組學 2024-12-23
- 溫州轉印膜工廠 2024-12-23
- 北京抑菌乳液公司 2024-12-23
- 福建熱凝牙托粉電話 2024-12-23
- 江蘇推薦創面敷料哪里有賣的 2024-12-23
- iPSC培養生物反應器材質安全性數據 2024-12-23
- 河南比較好的醫用刻錄機廠家批發價 2024-12-23
- 西藏5混1病毒采樣管出口企業 2024-12-23