《NC》解讀:FBXO7與PRMT1相互作用
FBXO7與PRMT1相互作用
第一步,探討PRMT1在肝細胞AI中上調的機制
已有結果顯示,PRMT1的蛋白水平在HCC中上調,但PRMT1 mRNA水平沒有變化。推測泛素-蛋白酶體降解可能參與PRMT1的上調。用兩種不同的蛋白酶體抑制劑處理細胞,發現PRMT1蛋白水平呈劑量依賴性增加(圖1a),表明PRMT1的蛋白水平可以通過泛素介導的降解來調節。
第二步,確定PRMT1降解的關鍵泛素連接酶
根據設計的篩選策略,E3泛素連接酶FBXO7為候選互作蛋白(圖1b-c)。IP-MS分析顯示FBXO7是前面十個與PRMT1相互作用的候選E3連接酶中唯獨的E3泛素連接酶(圖1d)。
第三步,確定FBXO7作為E3連接酶參與PRMT1的降解及其互作關系
外源、內源Co-IP實驗顯示FBXO7與PRMT1相互作用(圖1e-h)。Co-IP實驗發現,敲減PRMT1后,FBXO7與PRMT1相互作用減弱(圖1i-j)。另外,GST pulldown實驗證實FBXO7與PRMT1直接相互作用(圖1k)。
第四步,確定FBXO7與PRMT1結合的具體的位置
Co-IP分析發現PRMT1與FBXO7的結合需要PRMT1的催化結構域(23-162aa)(圖1l-n),而FBXO7與PRMT1的結合需要FBXO7的泛素樣結構域(UBL,1-78aa)和FBXO7-PI31二聚化結構域(FP,181-324aa)(圖1o-q)。表明FBXO7與PRMT1直接相互作用。
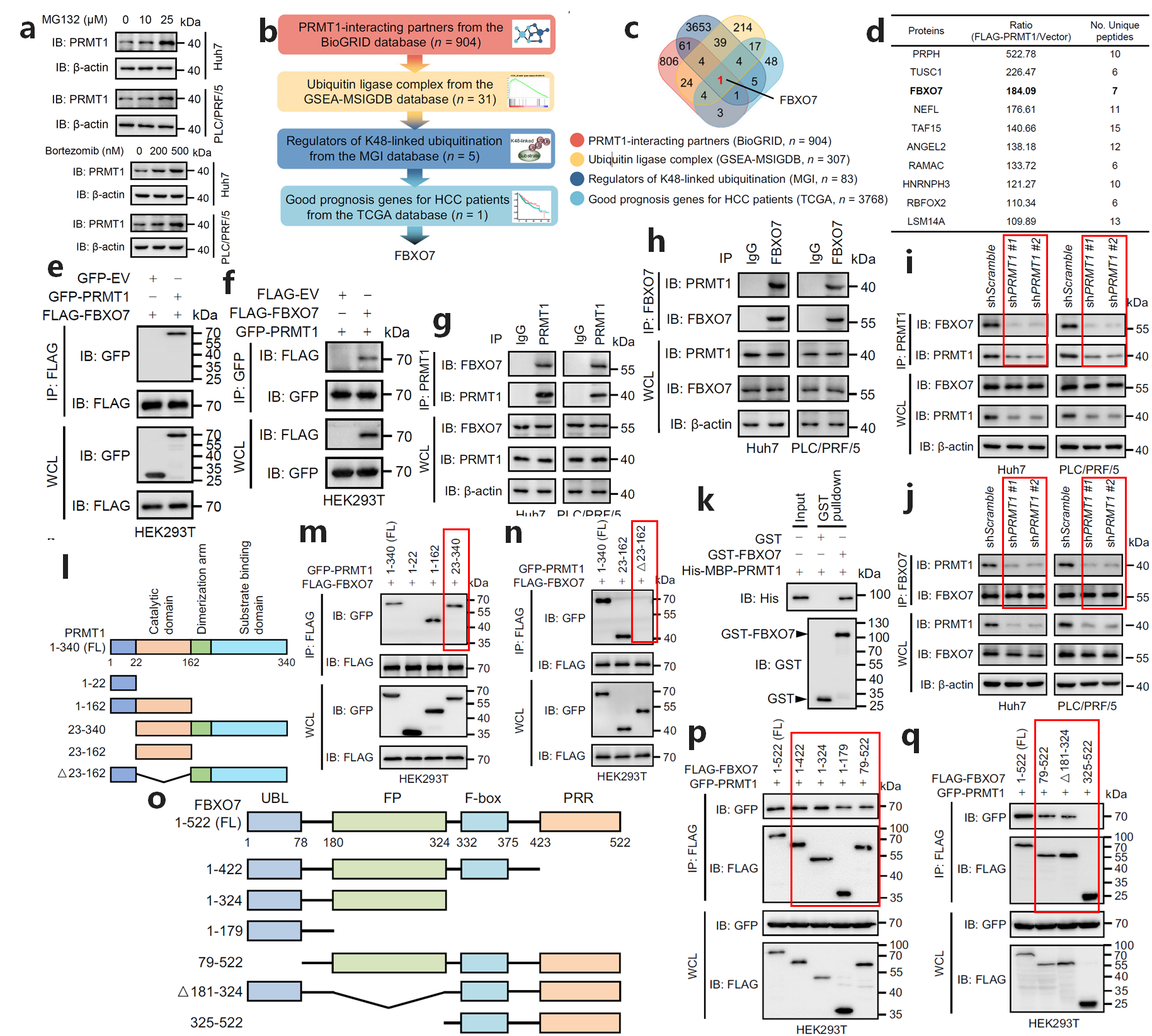
圖1 FBXO7與PRMT1相互作用(Ref. Fig 1/S1)
本文揭示FBXO7通過抑制肝AI絲氨酸合成發揮抑AI的功能和分子機制。具體而言,FBXO7作為E3泛素連接酶,直接與PRMT1相互作用,導致PRMT1泛素化和隨后的泛素-蛋白酶體降解。FBXO7介導的PRMT1降解可阻止PHGDH甲基化活化,從而抑制絲氨酸合成,加重氧化應激,抑制HCC生長。本研究揭示了FBXO7-PRMT1-PHGDH軸在肝AI絲氨酸代謝調節中的分子機制,為絲氨酸代謝的靶向診療提供分子基礎。
全文分享請查閱:【《NC》解讀:泛素化-甲基化-氨基酸代謝機制,FBXO7 泛素化 PRMT1、抑制PDGDH7甲基化-絲氨酸合成,發揮抑AI功能!】。
如有相關科研問題,歡迎留言探討。

